Essais cliniques versus recherches impliquant la personne humaine (RIPH) : en quoi les industries pharmaceutiques sont-elles concernées par la loi Jardé en France ?
La recherche médicale constitue un levier essentiel pour le développement de nouveaux traitements et pour l’amélioration continue de la prise en charge des patients.
En France, cette recherche est régie par des dispositions strictes visant à protéger les participants et à garantir l’intégrité de la personne humaine. La loi Jardé, adoptée en mars 2012 et pleinement appliquée depuis novembre 2016, constitue le cadre juridique pour les recherches impliquant les personnes humaines (RIPH).
En France, cette recherche est régie par des dispositions strictes visant à protéger les participants et à garantir l’intégrité de la personne humaine. La loi Jardé, adoptée en mars 2012 et appliquée depuis novembre 2016, est le cadre juridique pour les recherches impliquant les personnes humaines (RIPH).
Articulation entre la loi Jardé et le cadre européen des essais cliniques
Rappelons que les médicaments faisant l’objet d’essais cliniques sont encadrés en premier lieu par le règlement (UE) 536/2014 relatif aux essais cliniques (Clinical Trial Regulation – CTR), entré en vigueur le 31 janvier 2022. Ce règlement a abrogé et remplacé la directive 2001/20/CE. Depuis cette date, les essais cliniques sur les médicaments doivent être soumis via le Clinical Trials Information System (CTIS). Pour rappel, tout essai clinique disposant d’au moins un site investigateur encore actif en France au 31 janvier 2025 a dû faire l’objet d’une demande de transition vers le CTIS, par son promoteur. L’Avis aux promoteurs de l’ANSM apporte les aspects pratiques liés au dépôt de dossiers.
La loi Jardé ne se substitue pas au CTR, mais vient compléter le dispositif européen par des exigences nationales spécifiques, notamment en matière de protection des personnes, de consentement et d’information, de classification des recherches, et de procédures impliquant les Comités de Protection des Personnes (CPP).
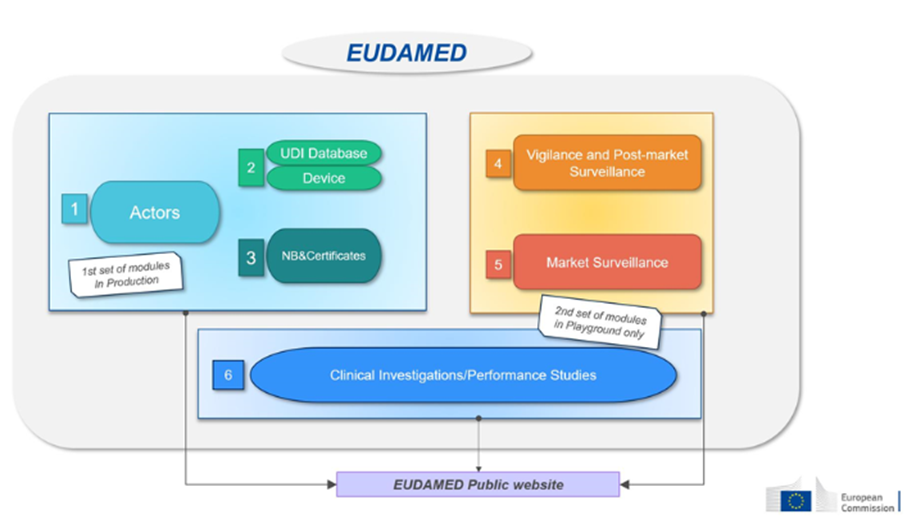
D’autres dispositions réglementaires sont également à intégrer par les promoteurs, telles que les démarches sur la protection des données personnelles (RGPD, méthodologies de référence CNIL), les démarches relatives à l’utilisation de médicaments composés en tout ou partie d’organismes génétiquement modifiés (OGM) et les règles spécifiques applicables à certains produits de santé. En effet, selon la nature de l’objet de recherche, les dispositions applicables diffèrent. La loi Jardé couvre ainsi : les médicaments, les dispositifs médicaux (investigation clinique), les DMDIV (étude de performance), les produits de thérapie cellulaire, tissus, organes, les produits sanguins labiles (PSL), mais aussi certaines recherches portant sur les compléments alimentaires ou les cosmétiques.
Qu’est-ce que la loi Jardé ?
La loi Jardé, du nom du député Olivier Jardé, est un texte qui encadre les conditions dans lesquelles des recherches impliquant la personne humaine peuvent être menées en France. Elle remplace la loi Huriet-Sérusclat de 1988 et vise à renforcer la protection des participants tout en simplifiant et en harmonisant les procédures, en tenant compte du niveau de risque encouru.
Les principaux textes de référence incluent ainsi :
- La loi Jardé, loi n° 2012-300 du 5 mars 2012 relative aux recherches impliquant la personne humaine.
- L’ordonnance, dite « loi Jardé modifiée », relative aux recherches impliquant la personne humaine.
- Le décret n° 2016-1537 du 16 novembre 2016 relatif aux recherches impliquant la personne humaine.
Classification des RIPH
Les recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances biologiques ou médicales sont désignées par les termes « recherche impliquant la personne humaine ».
Il existe trois types de RIPH :
| Catégorie | Dispositions légales | Cadre |
| Catégorie 1 : Recherches interventionnelles comportant un risque pour les participants (intervention non justifiée par la prise en charge habituelle) | Articles L1121-1 à L1121-17 du CSP | Elles nécessitent une autorisation préalable de l’ANSM et un avis favorable d’un Comité de Protection des Personnes (CPP). |
| Catégorie 2 : Recherches interventionnelles avec des risques et des contraintes minimes * | Article L1121-1 à L1121-17 du CSP | Elles requièrent un avis favorable d’un CPP, mais pas d’autorisation de l’ANSM. |
| Catégorie 3 : Recherches non interventionnelles (études observationnelles – risques négligeables) | Article L1121-1-1 du CSP | Elles requièrent un avis favorable d’un CPP, mais pas d’autorisation de l’ANSM. |
* Les recherches portant sur des médicaments ne peuvent en principe pas relever de la catégorie 2, sauf cas très spécifiques définis réglementairement. Un arrêté donne les critères à respecter pour rester dans le champ des RIPH 2.
Quelles conséquences pour les industriels ?
Information et consentement des participants
L’objectif de la loi Jardé est de garantir la sécurité des participants. Une attention toute particulière est portée sur les notions de consentement libre et éclairé et d’information claire, compréhensible et loyale.
Les industriels, en tant que promoteurs, doivent s’assurer que les participants comprennent bien les enjeux, les procédures, les risques et contraintes et les bénéfices potentiels de l’étude. Ces exigences sont détaillées dans les articles L1122-1-1 à L1122-2 du CSP.
Détermination des autorités compétentes et procédures applicables
Les promoteurs doivent déterminer la catégorie de leur recherche dès la phase de conception, s’assurer qu’ils obtiennent les autorisations nécessaires (CPP et / ou ANSM) et définir la procédure applicable (CTR/CTIS pour les médicaments).
Interactions avec les CPP et l’ANSM
Les CPP sont les comités d’éthique français (Comités de Protection des Personnes) chargés d’évaluer la protection des participants, la qualité de l’information et du consentement et la balance bénéfice/risque. Les relations avec les CPP et l’ANSM sont essentielles pour la validation des projets de recherche. Une bonne communication et une soumission de dossiers complets sont nécessaires, conformément aux articles L1123-6 et L1123-7 du CSP. Un CPP en charge de l’évaluation du dossier est tiré au sort pour chaque RIPH. Le système d’information des recherches impliquant la personne humaine (SI RIPH 2G) permet de déposer un dossier de demande d’avis et obtenir la désignation aléatoire d’un CPP. La plateforme permet aussi de déclarer les volontaires sains participants à une étude.
Démarches et procédures
Préalablement au dépôt du dossier de demande d’autorisation (autorisation initiale et modification substantielle) et/ou d’avis de recherche impliquant la personne humaine, ou de recherche de soins courants, les promoteurs doivent obtenir un numéro d’enregistrement ID-RCB de la recherche. Ce numéro permet d’identifier chaque recherche réalisée en France. Pour une demande d’autorisation et d’avis de recherche interverventionnelle portant sur un médicament à usage humain, les promoteurs doivent obtenir à la place un numéro d’enregistrement de la recherche dans la base de données européenne CTIS (auparavant : EudraCT).
Ensuite, les promoteurs adresseront le dossier de demande d’autorisation de recherche biomédicale et/ou d’avis, par voie électronique, à l’ANSM et/ou au CPP, conformément aux arrêtés en vigueur fixant les formats de dossier propre à chaque type de recherche. Différents « Avis aux promoteurs » encadrent ces démarches selon la situation.
Conclusion
La loi Jardé assure ainsi la sécurité des participants aux recherches cliniques en France.
Pour les industriels de santé, comprendre et respecter ces règlementations est non seulement une obligation légale, mais aussi un gage de qualité des données générées en vue notamment de leur utilisation dans un dossier d’AMM.
En intégrant les exigences de la loi Jardé dans leurs processus, les industriels contribuent au développement de traitements innovants tout en garantissant des standards éthiques élevés, conformément aux exigences françaises et européennes sur ce sujet.
Atessia vous accompagne dans la mise en œuvre de ces process avec son expertise sur les essais cliniques.
Article rédigé par Mathilde ISRAEL