ATESSIA est certifiée Great Place To Work® 2025-2026
Atessia est fière de l’obtention de la certification Great Place To Work® pour l’année 2025-2026.
Cette distinction repose exclusivement sur les retours anonymes et directs des collaborateurs concernant leur expérience au sein d’Atessia.
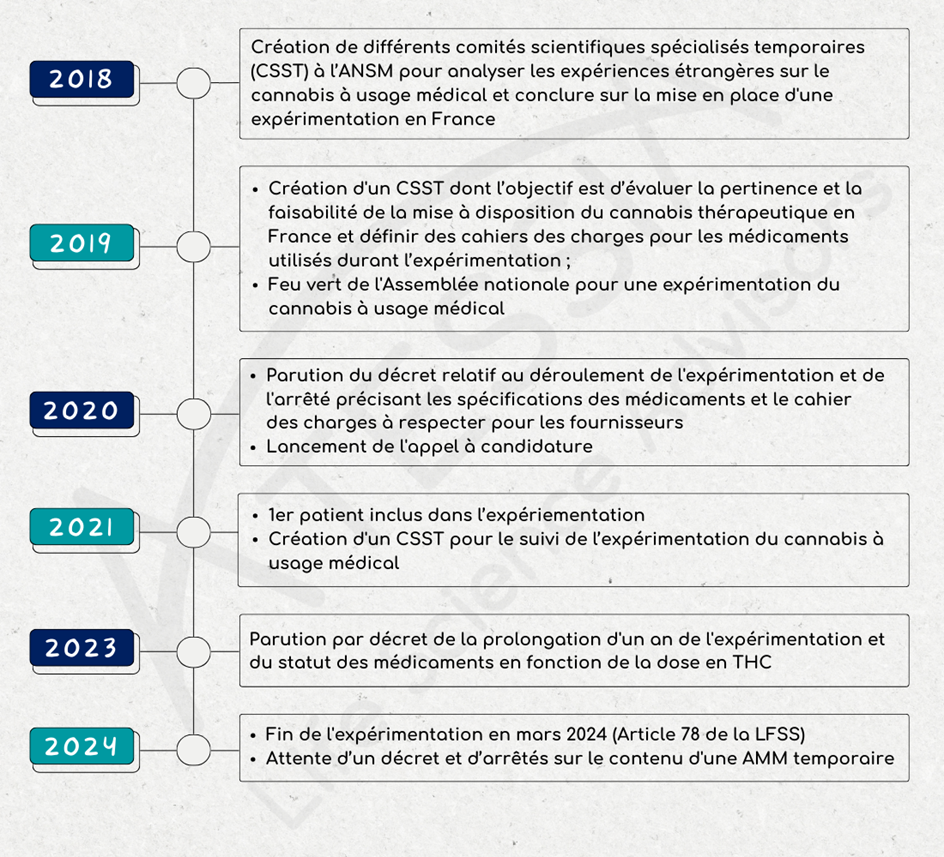
La moyenne globale du modèle Great Place to Work® ressort également à 85 %, confirmant la solidité des fondations culturelles de l’entreprise, autour de trois piliers clés : la confiance, la fierté et la convivialité.
Ces dimensions structurent le quotidien d’Atessia et se reflètent dans la manière dont les équipes travaillent, collaborent et s’engagent collectivement.
Great Place To Work® est l’organisme mondial de référence en matière de culture d’entreprise, d’expérience collaborateur et de pratiques managériales favorisant la performance durable, l’engagement et l’innovation
« La certification Great Place To Work® est une reconnaissance très convoitée, qui exige un engagement constant et sincère envers l’expérience collaborateur », Sarah Lewis-Kulin, Vice-Présidente Global Recognition chez Great Place To Work®. « Cette distinction repose uniquement sur le feedback en temps réel des collaborateurs. En l’obtenant, Atessia démontre qu’elle fait partie des entreprises offrant un environnement de travail de grande qualité. »

« Cette certification reflète un cadre de travail construit avec constance et exigence. Elle traduit la qualité des pratiques mises en place et leur appropriation au quotidien. C’est un indicateur utile, qui confirme ce qui fonctionne et ce qui doit continuer à être consolidé dans le temps. »

Présidente Atessia & Co.
« L’expérience collaborateur au sein d’Atessia s’appuie sur une culture de l’expertise et de la transmission, un environnement de travail à la fois bienveillant et exigeant, et une organisation fondée sur l’autonomie, la responsabilisation et la confiance. “

Responsable Ressources Humaines


Selon Great Place To Work
Selon les études Great Place To Work®, les candidats ont 4,5 fois plus de chances de trouver un management de qualité dans une entreprise certifiée.
Les collaborateurs des entreprises certifiées sont également 93 % plus enclins à se réjouir d’aller travailler, et deux fois plus susceptibles de percevoir une rémunération équitable, des opportunités d’évolution justes et un partage équilibré de la valeur créée.
Des points d’excellence clairement identifiés
Parmi les résultats, certains scores se distinguent particulièrement et constituent de véritables marqueurs culturels.
- La solidarité atteint 100 %.
Ce score exceptionnel signifie que l’entraide et le soutien entre collègues sont perçus comme systématiques. C’est une force rare, qui reflète une culture profondément collective.
- Les relations interpersonnelles et la convivialité culminent à 92 %.
Ces résultats traduisent un environnement de travail où les relations humaines sont perçues comme saines, respectueuses et positives, et où la qualité du lien reste centrale malgré les enjeux opérationnels.
- La justice atteint 94 %, l’un des scores les plus élevés de l’enquête.
Ce résultat met en évidence une perception forte d’équité dans les décisions, les règles et les pratiques. Il constitue un pilier essentiel pour instaurer durablement la confiance.
- L’intégrité (89 %), la fierté (87 %) et l’engagement (87 %) confirment un alignement solide entre les valeurs portées par l’entreprise et leur traduction concrète dans le quotidien.

Parmi les affirmations les mieux évaluées dans l’enquête figurent notamment :
- « Ici, on peut compter sur l’aide de collègues »
- « Les collaborateurs sont traités équitablement »
- « Nous sommes attentifs les uns aux autres »
- « Le management gère l’entreprise de façon honnête et éthique »
Toutes ont obtenu 100 % de réponses positives.
Elles illustrent une culture fondée sur la solidarité, l’équité, l’attention et l’intégrité – des valeurs vécues concrètement et perçues de manière homogène.
À propos d’ATESSIA
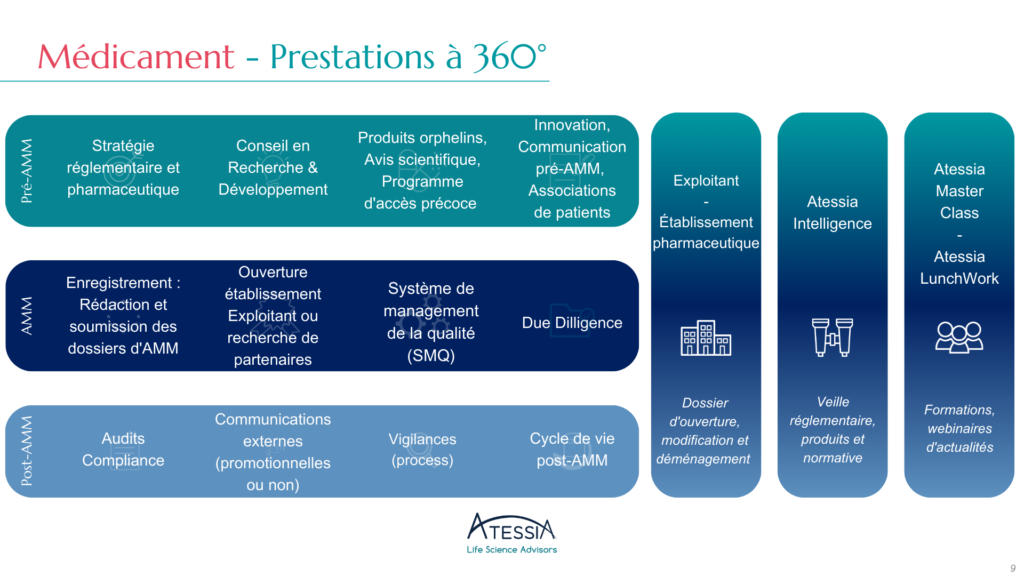
Atessia est un cabinet de conseil et d’expertise spécialisé dans les sciences de la vie, accompagnant des acteurs français, européens et internationaux sur des projets à forts enjeux réglementaires, pharmaceutiques et organisationnels.
Atessia accompagne ses clients à chaque étape du cycle de vie de leurs produits, en intervenant notamment en affaires réglementaires, vigilances, activités d’exploitant, qualité, et accompagnement stratégique, avec une approche rigoureuse, opérationnelle et adaptée aux besoins spécifiques de chaque contexte.
Le cabinet se distingue par une culture de l’expertise et de la rigueur, associée à une forte capacité d’adaptation aux environnements complexes et évolutifs du secteur de la santé.
La qualité constitue un axe structurant du fonctionnement d’Atessia. Le cabinet est engagé dans une démarche d’amélioration continue et s’appuie sur un système de management de la qualité certifié ISO 9001, garantissant la fiabilité des processus, la maîtrise des risques et la conformité des prestations délivrées.
Aujourd’hui, Atessia figure parmi les cabinets de référence du marché sur ces expertises.
À propos de la certification Great Place To Work®
La certification Great Place To Work® est la reconnaissance de référence pour les employeurs de choix. Elle repose exclusivement sur l’évaluation de l’expérience collaborateur, notamment le niveau de confiance vécu au quotidien. Chaque année, plus de 10 000 entreprises dans plus de 60 pays candidatent à cette certification.
Grâce à sa plateforme propriétaire et au modèle For All™, l’organisme accompagne les entreprises dans l’évaluation et l’amélioration de l’expérience de l’ensemble de leurs collaborateurs.