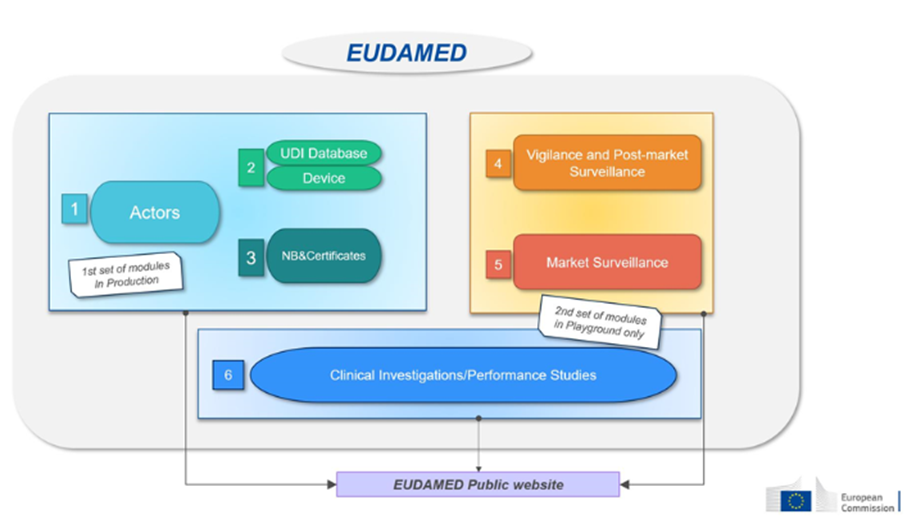
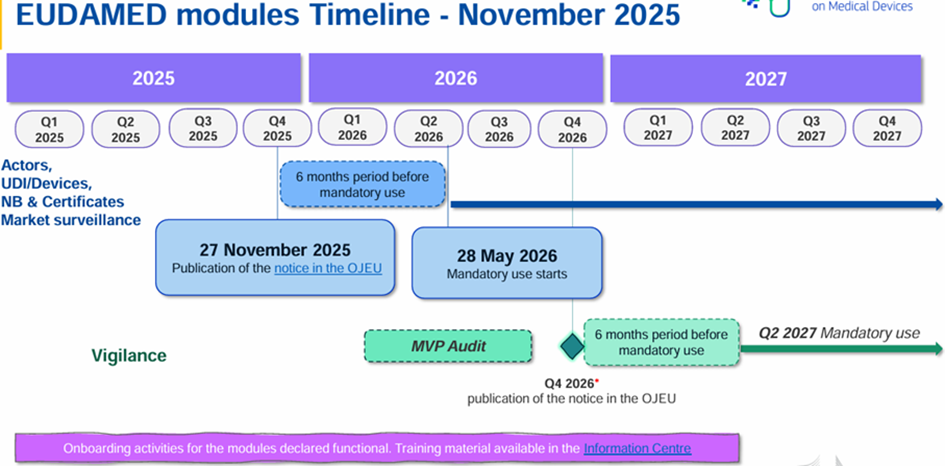
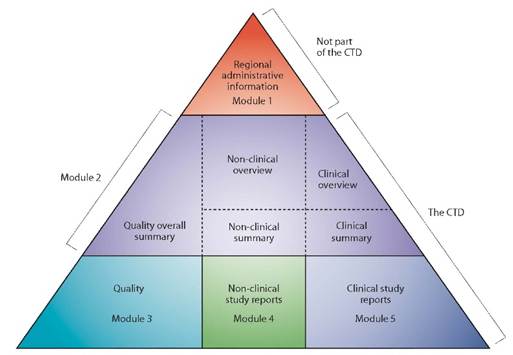
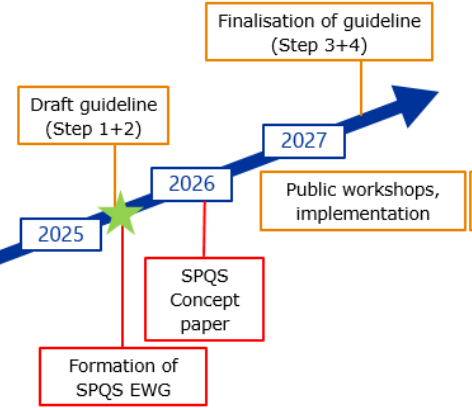
La Procédure Centralisée
La procédure centralisée est définie par le Règlement (CE) n° 726/2004 du Parlement européen et du Conseil du 31 mars 2004, établissant des procédures communautaires pour l’autorisation et la surveillance en ce qui concerne les médicaments à usage humain et à usage vétérinaire, et instituant l’Agence européenne des médicaments (EMA).
Cette procédure permet d’obtenir une autorisation de mise sur le marché (AMM) unique, délivrée par la Commission européenne, valable dans l’ensemble des États membres de l’Union européenne ainsi que dans les États membres de l’Espace Économique Européen (EEE) : l’Islande, le Liechtenstein et la Norvège.
1/ Champ d’application
La procédure centralisée est obligatoire pour certaines catégories de médicaments, à savoir :
- les médicaments de thérapie innovante (advanced therapies)
- les médicaments issus des biotechnologies
- les médicaments contenant une nouvelle substance active non autorisée utilisé dans le traitement du syndrome d’immunodéficience acquise (SIDA), du cancer, des maladies neurodégénératives, du diabète, des maladies auto-immunes et autres dysfonctionnements immunitaires et des maladies virales
- les médicaments désignés comme médicaments orphelins.
Elle est optionnelle pour d’autres catégories de médicaments qui, bien que ne relevant pas du champ obligatoire, peuvent présenter un intérêt à l’échelle européenne. Il s’agit :
- des médicaments contenant une nouvelle substance active qui, au 20 mai 2004, n’était pas autorisée dans l’Union européenne
- des médicaments constituant une innovation significative sur le plan thérapeutique, scientifique ou technique
- des médicaments présentant un intérêt au niveau communautaire pour les patients.
Les médicaments génériques d’un médicament de référence autorisé dans l’Union peuvent également être éligibles à la procédure centralisée.
2/ Les acteurs impliqués
Le Comité des médicaments à usage humain (CHMP), organe scientifique de l’EMA, est au cœur de la procédure centralisée. Pour s’acquitter des tâches en matière de pharmacovigilance, le CHMP s’appuie sur l’évaluation scientifique et les recommandations du Comité pour l’évaluation des risques en matière de pharmacovigilance (PRAC).
Les principaux acteurs sont :
- Le demandeur : le titulaire du dossier d’AMM.
- Les rapporteurs et co-rapporteurs : deux États membres désignés par le CHMP pour évaluer le dossier et rédiger les rapports d’évaluation.
- Le CHMP : responsable de l’examen scientifique et de la formulation d’un avis sur le rapport bénéfice/risque du médicament.
- La Commission européenne : autorité compétente pour la décision finale d’AMM, sur la base de l’avis du CHMP.
3/ Calendrier
La durée totale d’évaluation scientifique est de 210 jours, hors arrêts d’horloge (clock-stops) permettant au demandeur de répondre aux questions du CHMP.
Pré-soumission
Le demandeur peut organiser une réunion de pré-soumission (Pre-submission meeting) avec l’EMA. Ces réunions constituent une opportunité essentielle pour obtenir des avis procéduraux et réglementaires de l’Agence et s’assurer que le dossier est conforme aux exigences de la procédure centralisée.
Soumission et validation
Le dossier complet est soumis via le portail de l’EMA. Une validation technique est réalisée, portant sur la structure du dossier (eCTD), ainsi qu’une validation du contenu administratif et réglementaire. Une fois ces validations terminées, l’évaluation scientifique commence officiellement le Jour 1 (J1).
1er tour d’évaluation (J1 à J120)
Les rapporteurs et co-rapporteurs désignés par le CHMP réalisent leur première évaluation scientifique et rédigent un rapport d’évaluation préliminaire, consolidé avec les commentaires des autres membres du CHMP.
Une peer review est ensuite menée par le rapporteur et le co-rapporteur pour harmoniser les avis et finaliser la liste des questions à adresser au laboratoire. Le J120 marque le début de la période de clock-stop, pendant laquelle le laboratoire dispose généralement d’un délai pouvant aller jusqu’à trois mois pour préparer son document de réponses aux questions. Le temps de réponse n’est pas compté dans les 210 jours réglementaires.
2ème tour d’évaluation (J121 à J210)
Après la période de clock-stop, le CHMP reprend l’évaluation scientifique sur la base des réponses fournies par le laboratoire (J121). Cette phase permet de vérifier que toutes les questions ont été correctement traitées et de finaliser le rapport d’évaluation (joint assessment) (J150).
Si certaines questions restent en suspens ou si un point nécessite clarification, le CHMP peut organiser un second clock-stop, pendant lequel le laboratoire fournit les informations complémentaires (J180).
Après ce second clock-stop, une oral explanation (explication orale) peut être organisée pour donner suite à une requête du demandeur ou à la demande du CHMP (J181). Cette audience est généralement organisée lorsque le CHMP conserve des objections majeures et permet au laboratoire de répondre directement aux points critiques soulevés par le comité.
Une fois toutes les réponses aux questions reçues, le rapport peut être finalisé et le CHMP adopte son avis final sur la balance bénéfice/risque du médicament (J210). Cet avis peut être positif, adopté soit par consensus, soit à la majorité absolue des membres, ou négatif. En cas d’avis négatif, le laboratoire a la possibilité de faire appel (re-examination) de la décision conformément aux procédures de l’EMA.
Décision de la Commission européenne
Lorsque l’avis du CHMP est positif, la Commission européenne dispose de 67 jours pour prendre la décision finale d’octroi de l’autorisation de mise sur le marché.
4/ En résumé
La procédure centralisée est la voie d’autorisation privilégiée et la plupart du temps obligatoire pour les médicaments innovants souhaitant une présence européenne. Elle garantit une évaluation scientifique harmonisée. Toutefois, sa complexité requiert une préparation stratégique solide et une expertise réglementaire confirmée.
| ATESSIA accompagne les entreprises pharmaceutiques dans la définition de leur stratégie d’enregistrement, la préparation et la soumission des dossiers en procédure centralisée, ainsi que dans la gestion des interactions avec l’EMA et la Commission européenne. |
Article rédigé par Lamya SAOUSSEN, Consultante Junior en Affaires Réglementaires et Communications Externes