Atessia accompagne ses clients au quotidien sur les modalités pratiques de mise en place du dispositif d’accès précoce et compassionnel français, dont les subtilités requièrent quelques explications.
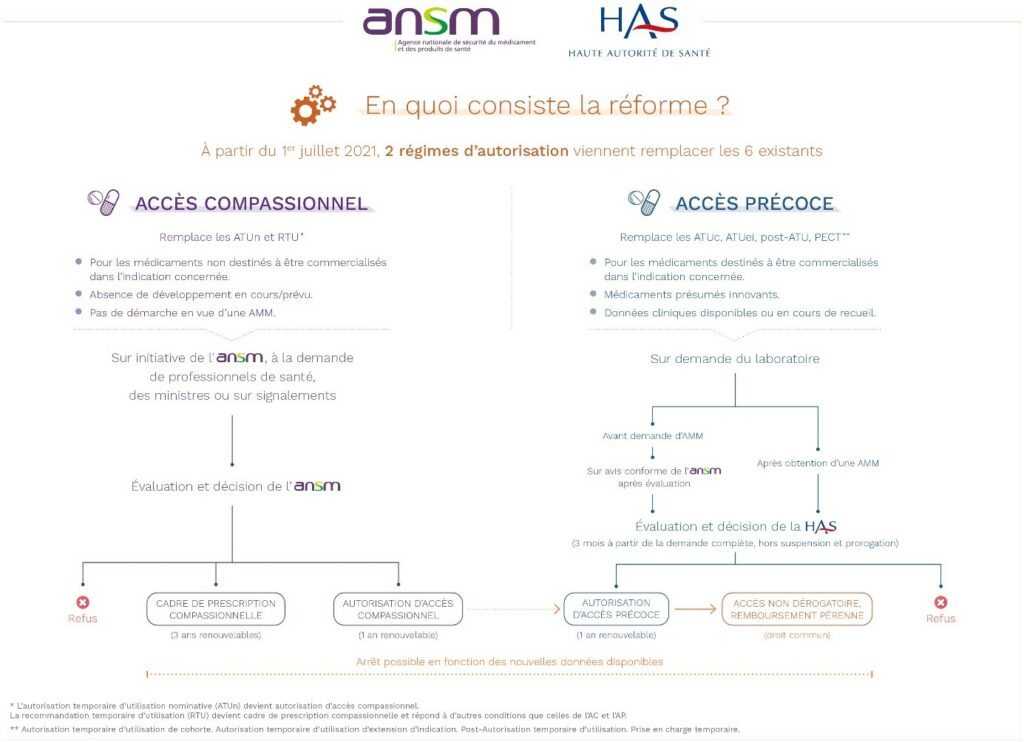
Le 1 juillet 2021, le nouveau dispositif d’accès précoce et compassionnel est paru au travers de 2 décrets, complétés de 4 arrêtés avec une entrée en vigueur immédiate.
Ce nouveau dispositif s’articule selon 2 mécanismes d’accès et de prise en charge par l’assurance maladie:
- L’accès précoce (AAP)
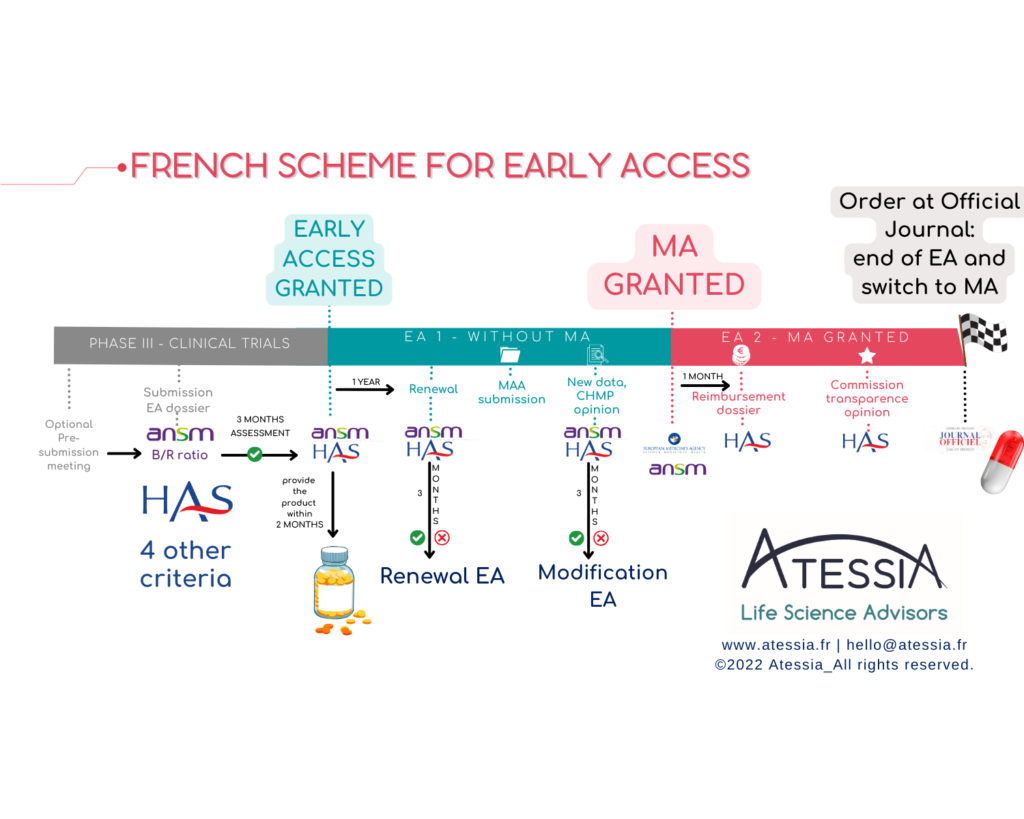
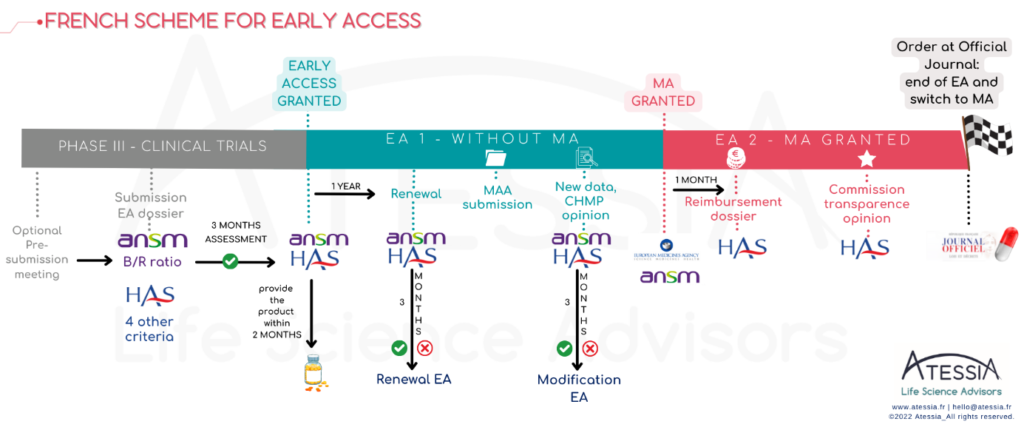
L’accès précoce tout d’abord, qui vise les médicaments, répondant à un besoin thérapeutique non couvert, et susceptibles d’être innovants. Le laboratoire dépose une demande d’autorisation d’accès précoce (AAP) auprès de la Haute Autorité de santé (HAS) et, pour les médicaments qui ne sont pas encore autorisés dans le cadre d’une AMM, , auprès de l’Agence nationale de sécurité du médicament et des produits de santé (ANSM).
Ces autorisations peuvent s’appliquer à :
– un médicament en amont de l’obtention de l’AMM dans l’indication considérée (AAP Pré-AMM = AP1),
– un médicament qui dispose d’une déjà d’une AMM dans l’indication considérée, en amont d’une prise en charge de droit commun par l’assurance maladie (AAP Post-AMM = AP2)
Point intéressant, le produit peut disposer ou pas d’une AMM pour une autre indication.
Comme l’indique la doctrine de la HAS, l’octroi d’une autorisation d’accès précoce est réservé à certaines spécialités remplissant les 5 critères d’éligibilité cumulatifs suivants :
- l’efficacité et la sécurité sont fortement présumées dans l’indication considérée
- La maladie à traiter est grave, rare ou invalidante
- Il n’existe pas de « traitement approprié »
- La mise en œuvre du traitement ne peut être différée
- Le médicament est présumé innovant.
Les autorités examinent séparément l’ensemble de ces critères, de manière relativement stricte.
Ce dispositif requière également des engagements concrets de la part des laboratoires, qu’il ne faut pas sous-estimer et qui sont à soupeser avec la maison mère.
- D’un point de vue REGLEMENTAIRE : le laboratoire doit s’engager à déposer une demande d’AMM dans les 2 ans pour une AAP1 ou une demande d’inscription dans le mois suivant l’obtention de l’AMM pour une AAP2. Ainsi, le timing de dépôt est crucial dans le projet.
- D’un point de vue LOGISTIQUE : le laboratoire met à disposition le produit dans les 2 mois suivants l’octroi de l’AAP (PUI) et s’assure de pouvoir fournir le produit pour permettre la continuité des traitements des patients initiés pendant toute l’AAP, pendant un délai minimal d’un an (dont 3 mois de prise en charge).
- D’un point de vue FINANCIER : le laboratoire met en place un PUT-RD, pour le recueil des données, et la transmission des rapports périodiques de synthèse. Le laboratoire financer ce recueil de données (cf. convention à signer avec les établissements de santé).
- Le laboratoire pharmaceutique est également tenu d’accompagner les prescripteurs dans la saisie et le suivi de la collecte des données de suivi en vie réelle du médicament, en leur apportant les moyens nécessaires.
- Deux types d’accès compassionnels
Ce dispositif vise deux cas de figure distincts, qui ont en commun le fait de concerner un médicament permettant de traiter des patients souffrant de maladies sans traitement approprié, dans une indication thérapeutique donnée, sans qu’il ne soit destiné à obtenir une AMM en France. Les demandes sont gérées par l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) uniquement.
- Soit cet accès compassionnel est demandé pour un médicament non autorisé et non disponible en France par un prescripteur hospitalier pour un patient nommément désigné, sous réserve que l’ANSM soit en capacité de présumer d’un rapport bénéfice/risque favorable pour une maladie grave, rare ou invalidante : c’est une autorisation d’accès compassionnel (AAC) individuelle et nominative.
- Soit il s’agit de l’encadrement d’une pratique, à l’initiative de l’ANSM, en vue de sécuriser une pratique de prescription hors AMM d’un médicament disponible en France, disposant d’une AMM dans d’autres indications, lorsqu’il fait l’objet d’une prescription hors AMM bien établie sur le territoire français : c’est un cadre de prescription compassionnelle (CPC).
Des dérogations à l’accès compassionnel ont été prévues dans les cas suivants :
- Permettre un accès nominatif à des médicaments en développement dans l’indication : il s’agit d’un accès compassionnel « très précoce ».
- Le PLFSS pour 2024 prévoit également la possibilité d’octroi d’autorisations d’accès compassionnel en cas de refus d’accès précoce pour motif que le médicament n’est pas assez innovant.
L’octroi par l’ANSM est soumis à plusieurs conditions d’éligibilité, qui rapproche ce dispositif de l’accès précoce et peuvent en être la porte d’entrée:
- la mise en œuvre du traitement ne peut être différée ;
- le patient ne peut pas participer aux éventuelles recherches en cours ;
- l’entreprise qui assure l’exploitation du médicament doit s’engager à déposer une demande d’accès précoce dans les 12 mois suivant la première autorisation « compassionnelle pré-précoce » (18 mois pour les maladies rares).
Pour ces dispositifs, la désignation d’un laboratoire exploitant d’un médicament peut être rendue nécessaire, pour assurer le cas échéant l’importation/distribution, la pharmacovigilance, les réclamations qualité ou l’information médicale.
Les laboratoires disposent désormais de plusieurs années d’expérience sur ces nouveaux dispositifs, et les tendances qui se dégagent montrent de la part des autorités un volontarisme à mettre à disposition des patients français des médicaments innovants et de répondre aux situations personnelles de patients en impasse thérapeutique.
Article rédigé par Caroline LECUELLE, Consultante Affaires Réglementaires & Pharmaceutiques