Quelles interactions possibles entre industriels de la santé et professionnels de santé en France ?
La visite médicale en France désigne les interactions à caractère promotionnel auprès des professionnels de santé menées par les collaborateurs habilités de l’industrie pharmaceutique.
De la réforme structurelle de l’assurance maladie instaurée par la loi du 13 août 2004 découle la 1ère Charte de la Visite Médicale dont l’objectif était de mieux encadrer les pratiques commerciales et promotionnelles des laboratoires qui pourraient nuire à la qualité des soins (création de l’Article L.162-17-8 du Code de la sécurité sociale).
Depuis 2008, le champ d’application de la charte a été élargi pour inclure notamment les prescripteurs exerçant en établissements de santé, et non plus seulement ceux issus des cabinets de ville. La dernière version de la Charte date du 15 octobre 2014 et s’intitule désormais la « Charte de l’information par démarchage ou prospection visant à la promotion des médicaments ».
Toutes les entreprises pharmaceutiques disposant d’une autorisation d’ouverture en tant qu’exploitant, et ayant signé une convention avec le CEPS (médicaments remboursables) doivent s’engager à respecter la Charte déclinée en un référentiel élaboré par la Haute Autorité de Santé (HAS) dont la dernière version en vigueur date de mars 2017, ainsi que les Q&A qui ont suivi et notamment le dernier en date du 20 mars 2025. Ce référentiel se traduit comme la procédure permettant l’application pratique de la Charte et c’est sur la base de cette procédure (référentiel de certification) que des organismes certificateurs, accrédités par le Comité français d’accréditation (COFRAC), certifient les entreprises pour leur activité de promotion qu’elle soit en ville ou en milieu hospitalier. Cette procédure regroupe deux volets, l’un dédié à la certification de l’activité réalisée par les entreprises exploitantes (EPE) elles-mêmes, pour leur propre compte ou en Co-promotion, ainsi que les exigences que les EPE doivent satisfaire en cas de sous-traitance de tout ou d’une partie de leur activité promotionnelle ( chapitre 5 du référentiel). Le deuxième volet est, quant à lui, dédié à la certification de l’activité promotionnelle réalisée par les entreprises sous-traitantes (EST).
Les entreprises soumises à ce dispositif doivent mettre en place un système de management de la qualité permettant de répondre de manière pérenne aux exigences de la Charte et de son référentiel :
- Au chapitre 1 : Définition, mise en œuvre et suivi de la politique qualité pour cette activité (audit interne, revue qualité annuelle, gestion des capas, gestion des documents promotionnels…)
- Au chapitre 2 : Formation initiale/intégration /continue et évaluation des connaissances des collaborateurs VM (7 thèmes réglementaires et 2 thèmes scientifiques), évaluation en aléatoire et parcours individuel de formation
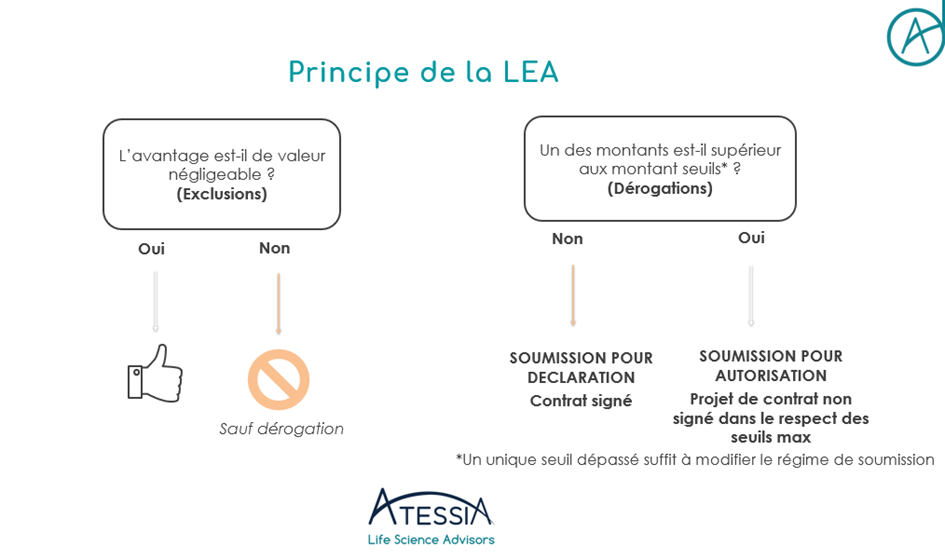
- Au chapitre 3 : Respect des règles de déontologie vis-à-vis des patients, des professionnels de santé, des entreprises concurrentes, de son entreprise et de l’assurance maladie, comprenant la réglementation LEA (loi d’encadrement des avantages ) et le règlement RGPD ( mise à jour du Q&A de mars 2025).
- Au chapitre 4 et 5 : Co-promotion et recours à la sous-traitance (contrat, responsabilité et organisation et suivi).
Les laboratoires pharmaceutiques doivent se préparer aux audits annuels de certification (N : certification, N+1 surveillance, N+2 surveillance, N+3 audit de renouvellement), revoir régulièrement leur système de management de la qualité, suivre l’activité de l’ensemble des fonctions transversales impliquées (marketing, affaires réglementaires, médical, collaborateurs terrains : MSL et collaborateurs promotionnels etc.). Parmi les enjeux, celui de garantir la conformité réglementaire de l’activité promotionnelle qui est l’un des piliers stratégiques pour les laboratoires et faire la distinction claire entre les activités de promotion et les activités médicales et scientifiques .
Le médicament n’est pas le seul concerné : la charte de qualité des pratiques professionnelles des personnes chargées de la présentation, de l’information ou de la promotion des dispositifs médicaux à usage individuel, des produits de santé autres que les médicaments et des prestations de service éventuellement associées parue au JO le 8 mars 2022 et dont la parution du référentiel d’application est prévu pour la fin d’année 2025 s’appliquera de manière concomitante aux laboratoires multiproduits concernés et aux entreprises du dispositif médical (« charte de qualité des pratiques professionnelles pour les produits et prestations remboursables »).
Le Q&A de mars 2025 vient mettre à jour les notions d’accès précoce et compassionnel, ainsi que la réglementation RGPD et LEA dans un référentiel qui fête ses 8 ans cette année.
Mais avec tout ça :
Que peuvent dire les visiteurs médicaux ? que peuvent-ils remettre aux médecins, et que doivent-ils leur remettre ? Que peut dire un KAM ou un MSL ? Et surtout, quels messages délivrer par rapport aux indications thérapeutiques de l’AMM, de l’accès précoce ou compassionnel, et au hors AMM, en tenant compte de la stratégie thérapeutique établie par la HAS ? Comment parler des résultats des essais cliniques ? Comment déclarer un congrès avec un orateur ? Un MSL peut-il former les Collaborateurs terrains ? Un délégué peut-il faire du référencement ?
Besoin d’un accompagnement pour vos audits internes, ceux de vos sous-traitants, pour la préparation à l’audit de certification, la rédaction des procédures ou la formation (7 thèmes réglementaires) de vos équipes terrain, ATESSIA vous accompagne.
Sandrine DE SOUSA, Consultante Senior Compliance et Qualité des communications externes