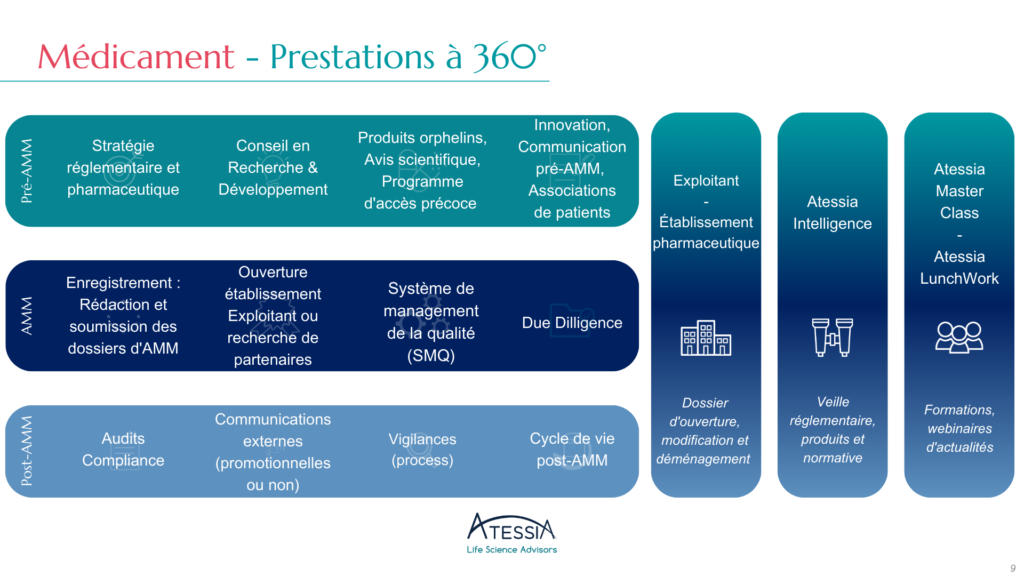
Qu’est-ce que la classification des variations d’AMM ?
Qu’est-ce que la classification des variations d’AMM ?
Lorsqu’un titulaire souhaite enregistrer un médicament dans un pays, il dépose auprès des autorités de santé un dossier de demande d’autorisation de mise sur le marché (AMM).
Une fois l’AMM obtenue, ce dossier n’est pas destiné à rester figé et inchangé. A chaque changement impactant le produit, que ce soit (par exemple) un changement de fabrication, de contrôle, d’indication thérapeutique, de conditionnement, le titulaire doit déposer auprès des autorités de santé une demande de variation.
Une variation est donc une modification de l’autorisation de mise sur le marché.
Les modifications des termes d’une autorisation de mise sur le marché européenne sont prévues par la directive 2001/83/CE et le règlement (CE) N° 726/2004, et détaillées par le règlement (CE) N° 1234/2008 du 24 novembre 2008 concernant l’examen des modifications des termes d’une AMM de médicaments à usage humain et de médicaments vétérinaires (ci-après dénommé règlement « Modifications »)
Ce règlement est applicable depuis le 1er janvier 2010 aux AMM obtenues en procédures centralisées, décentralisées et de reconnaissance mutuelle, et depuis le 4 août 2013 aux AMM obtenues en procédures nationales.
Il existe 3 types de variations :
- Les variations de type IA, dites mineures. Il s’agit de modifications dont les répercussions sur la qualité, la sécurité et l’efficacité du médicaments sont considérées minimales ou nulles. Ces modifications peuvent être mises en œuvre par le titulaire sans examen préalable par les autorités. Toutefois, au plus tard dans les douze mois à compter de la date de mise en œuvre, le titulaire doit notifier une telle modification simultanément à tous les États membres concernés, à l’autorité nationale compétente ou à l’EMA (selon le cas).
A noter qu’il existe des variations de type IAIN (IN = immediate notification). Elles peuvent aussi être mises en œuvre par le titulaire sans examen préalable par les autorités. En revanche, la notification auprès des autorités compétentes doit se faire dans les 14 jours suivant la mise en œuvre.
- Les variations de type IB. Également mineures, elles se définissent comme des variations qui ne sont ni mineures de type IA, ni majeures de type II, ni des extensions.
Au sein des variations de type IB, on trouve également les variations dites « unforeseen », c’est-à-dire non prévues par le règlement initial et qui sont évoquées à l’article 5.
- Les variations de type II, dites majeures. Il s’agit de modifications qui ne sont pas des extensions d’AMM et qui peuvent avoir des conséquences significatives en termes de qualité, sécurité et efficacité.
Les modifications des termes d’une AMM englobent également les extensions d’AMM et les mesures de restriction urgente pour des raisons de sécurité.
Les variations sont catégorisées en fonction du type de changement par les Lignes directrices relatives aux caractéristiques des différentes catégories de modifications, au déroulement des procédures prévues aux chapitres II, II bis, III et IV du règlement (CE) no 1234/2008 de la Commission du 24 novembre 2008 concernant l’examen des modifications des termes d’une autorisation de mise sur le marché de médicaments à usage humain et de médicaments vétérinaires et à la documentation à soumettre en vertu de ces procédures. Il existe des changement classés comme administratifs (A), relatifs à la qualité (B), ou relatifs à la sécurité, l’efficacité, ou la pharmacovigilance (C). Les changements D concernent les dossiers permanents du plasma et les dossiers permanents de l’antigène vaccinant.
Le double défi est donc de positionner correctement chaque changement selon son type et sa catégorie. Pour bénéficier du type indiqué dans la classification, il faut être en mesure de fournir la documentation prévue et remplir les conditions mentionnées, faute de quoi la demande de variation est susceptible d’être recatégorisée voire rejetée.
Une fois ces définitions établies, notons que les titulaires d’AMM ont la possibilité de présenter en une demande unique plusieurs modifications concernant une ou plusieurs AMM, dans les conditions déterminées par le règlement.
On parle alors de grouping. Il est important de mentionner que toutes les variations ne sont pas « regroupables » entre elles. Une stratégie réglementaire doit être mise en place.
Enfin, la procédure de worksharing ou répartition des taches est fortement recommandée. Elle permet aux titulaires d’AMM de présenter en une demande unique, la même modification de type IB, de type II ou le même groupe de modifications correspondant à l’un des cas visés à l’annexe III du règlement pour autant qu’il ne comporte pas de demande d’extension, lorsque ces éléments se rapportent à plusieurs AMM détenues par le même titulaire, quel que soit le type de procédure (toutes les combinaisons étant possibles), ou à plusieurs AMM purement nationales d’un même titulaire dans plus d’un Etat membre.
Elle a été instituée pour éviter la duplication des travaux d’évaluation de ces modifications: celles-ci sont examinées par une seule autorité, appelée «l’autorité de référence» et choisie parmi les autorités compétentes des États membres et l’EMA, pour le compte des autres autorités concernées.
Faites appel à ATESSIA pour vous accompagner dans l’élaboration de la stratégie réglementaire et la rédaction de vos dossiers de demandes de variations, quelle que soit la procédure d’enregistrement.
Article rédigé par Véronique LEWIN, Consultante Sénior en Affaires Pharmaceutiques – CMC