Transparence des liens d’intérêt : quelles obligations pour les laboratoires pharmaceutiques en France?
Instaurée à la suite de l’affaire « Médiator », et inspirée du Sunshine Act américain, la loi n° 2011-2012 du 29 décembre 2011 relative au renforcement de la sécurité sanitaire plus connue sous le nom de « Loi Bertrand » pose les fondements de la transparence des liens. Elle impose aux laboratoires pharmaceutiques de publier sur la plateforme publique « Transparence Santé » les liens qu’ils entretiennent avec les acteurs du système de santé
Cette loi vise en effet à restaurer la confiance du public vis-à-vis du système de santé en garantissant une meilleure visibilité sur les liens d’influence potentiels et en favorisant une pratique médicale plus éthique et indépendante.
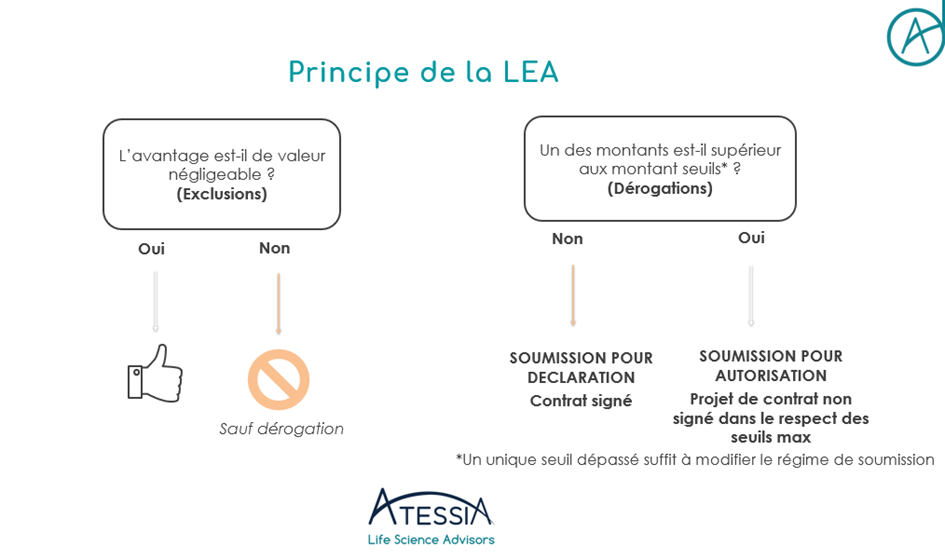
Le principe de Transparence des liens et la réglementation en matière d’encadrement des avantages sont deux dispositifs complémentaires mais distincts :
- La Loi d’Encadrement des avantages (articles L453-3 et suiv. et R1453-13 et suiv. du Code de la Santé publique) régit en effet l’octroi d’avantages entre industriels et professionnels de santé en instaurant notamment une déclaration préalable des conventions aux autorités compétentes.
- La Transparence des liens (articles L1453-1, L1453-2 et D1453-1 à R1453-12 du Code de la Santé publique) vise un périmètre plus large d’entreprises et d’acteurs de santé et s’applique même en l’absence d’avantages puisqu’il s’agit avant tout de publier les liens d’intérêt a postériori pour information du grand public.
Champ d’application
>Les entreprises et produits concernés
L’obligation de publier en transparence est applicable aux entreprises produisant ou commercialisant des produits de santé tels que les médicaments et dispositifs médicaux mais également les produits cosmétiques ou les médicaments vétérinaires.
(Pour rappel, ces deux dernières catégories de produits n’entrent pas dans le champ d’application de la LEA.)
Sont également visées les entreprises assurant des prestations associées aux produits de santé telles que les agences de communication en santé, la visite médicale, la recherche clinique.
>Les acteurs de santé concernés :
Les entreprises visées par le dispositif sont ainsi tenues de publier les liens qu’elles entretiennent avec les acteurs de santé français suivants :
| Professionnels de santé / étudiants | Personnes morales |
| Les professions règlementées : Médecins Pharmaciens, préparateurs en pharmacie et en pharmacie hospitalière Masseurs-kinésithérapeutes Sages-femmes, infirmiers, aides-soignants, auxiliaires de puériculture, diététiciens Chirurgiens-dentistes, assistants dentaires, Pédicures-podologues, Ergothérapeutes, psychomotriciens, orthophonistes, orthoptistes Manipulateurs d’électroradiologie médicale, techniciens de laboratoires médicaux Audioprothésistes, opticiens-lunetiers, prothésistes et orthésistes pour l’appareillage des personnes handicapées Ambulanciers Physicien médical Conseiller en génétique Les professions à usage de titres : Ostéopathes Chiropracteurs Psychothérapeutes | Associations (professionnels de santé, étudiants, patients) Établissements de santé : publics et privés académies, les fondations, les sociétés savantes et les sociétés ou organismes de conseil intervenant dans le secteur des produits, y compris cosmétiques, ou prestations de santé Éditeurs de presse, de services de radio ou de télévision et de services de communication au public en ligne Personnes qui, dans les médias ou sur les réseaux sociaux, présentent un ou plusieurs produits de santé, de manière à influencer le public (influenceurs) Éditeurs de logiciels d’aide à la prescription et à la délivrance Organismes assurant la formation initiale ou continue des professionnels de santé ou participant à cette formation |
Liens et avantages à publier
Il convient de rendre publics a posteriori :
- Les informations relatives aux conventions (objet de la convention, date, rémunérations/avantages, bénéficiaire direct, bénéficiaire final)
- Les informations relatives aux avantages dont le montant est supérieur ou égal à 10 € TTC
- Les informations relatives aux rémunérations dont le montant est supérieur ou égal à 10 €
A noter que les contrats commerciaux sont exclus du champ de la Transparence des liens ainsi que du dispositif d’encadrement des avantages.
La typologie des avantages et conventions de l’Arrêté du 24 septembre 2020 répond à des définitions précises qui ont été explicitées par les autorités.
Modalités de publication
La publication des informations doit être effectuée au moins deux fois par an via le site public Transparence-Santé :
> Pour la période du 1er janvier N au 30 juin N => soumission avant le 1er septembre N pour une publication le 1er octobre N
> Pour la période du 1er juillet N au 31 décembre N => soumission avant le 1er mars N+1 pour une publication le 1er avril N+1
Pour conclure :
Après plus de quinze ans d’application, le dispositif français de transparence des liens d’intérêt s’impose comme une référence en matière d’éthique et de régulation dans le secteur de la santé. Inspirée du Sunshine Act américain, la Loi Bertrand a renforcé la confiance du public et encadré les relations entre les industriels et les acteurs du système de santé.
Fortes de cette expérience, les entreprises ont fait de la transparence un pilier de leur conformité. Ce dispositif pionnier en Europe a ouvert la voie à une harmonisation accrue, notamment à travers le paquet pharmaceutique européen et les initiatives de l’EFPIA, prévoyant la publication annuelle des transferts de valeur.
L’extension récente du dispositif aux influenceurs témoigne de la capacité du modèle français à s’adapter aux nouveaux modes de communication et à maintenir un haut niveau d’exigence éthique dans un environnement en évolution constante.
Atessia accompagne ses clients dans les démarches de transparence des liens.
Article rédigé par Johanna DROUVILLE, Consultante Juridique