La PCVRR : Personne chargée de veiller au respect de la réglementation
L’article 15 du Règlement (UE) 2017/745 sur les dispositifs médicaux et l’article 15 du Règlement (UE) 2017/746 sur les dispositifs médicaux de diagnostic in vitro introduisent formellement l’exigence de désigner au sein de chaque fabricant (et de chaque mandataire) une Personne Chargée de Veiller au Respect de la Réglementation (PCVRR ou PRRC en anglais). Cette exigence vise à garantir la conformité permanente des dispositifs mis sur le marché, quelle que soit leur classe ou leur finalité médicale.
Cette obligation concerne l’ensemble des dispositifs :
- Implantables ou non implantables
- Actifs ou non actifs
- Produits standards ou sur mesure
- À finalité médicale ou non
Qui doit avoir une PCVRR ?
-Fabricants
Tous les fabricants de dispositifs médicaux mettant leurs dispositifs médicaux sur le marché de l’UE avec un marquage CE.
-Mandataires
Les mandataires européens, représentant des fabricants non-UE, sont également tenus de nommer une PCVRR.
Les autres opérateurs (distributeurs, importateurs, assembleurs) n’ont pas d’obligation d’avoir une PCVRR.
Missions et responsabilités de la PCVRR
Le rôle de la PCVRR couvre plusieurs domaines critiques du cycle de vie réglementaire d’un dispositif médical. Ses principales responsabilités sont définies comme suit :
- Vérification de la conformité des dispositifs avant leur libération, en s’appuyant sur le système de gestion de la qualité du fabricant.
- Élaboration et mise à jour de la documentation technique, y compris la déclaration de conformité UE.
- Obligation de surveillance après commercialisation : suivi des performances et de la sécurité après la mise sur le marché.
- Obligations de notification réglementaire auprès des autorités compétentes en cas d’incidents ou de changements majeurs.
- Déclarations en cas d’investigation clinique ou étude de performances, selon les exigences du règlement.
Garantie d’indépendance : Le règlement impose que la PCVRR n’encoure aucun désavantage dans l’exécution de ses missions, qu’elle soit salariée de l’entreprise ou non.
Qualifications requises pour exercer comme PCVRR
Deux voies d’accès sont possibles pour être éligible au poste de PCVRR, conformément au texte réglementaire :
- Voie académique + expérience
- Diplôme (ou certificat) en droit, médecine, pharmacie, ou autre discipline scientifique pertinente.
- Expérience professionnelle ≥ 1 an dans la réglementation ou les systèmes de gestion qualité liés aux dispositifs médicaux.
- Pour les dispositifs sur mesure : expérience ≥ 2 ans dans un domaine de fabrication pertinent.
- Voie professionnelle
- Une expérience professionnelle ≥ 4 ans dans la réglementation ou les systèmes qualité applicables aux dispositifs médicaux.
Organisation du rôle de PCVRR selon la taille de l’entreprise
Le règlement reconnaît les différences de structure entre grands groupes et PME :
- Grandes entreprises : la PCVRR doit faire partie intégrante de l’organisation, sans interruption.
- Micro et petites entreprises* : la PCVRR peut être externalisée, à condition qu’elle soit disponible en permanence et sans interruption.
Multiples PCVRR : Si plusieurs personnes sont désignées, elles sont alors solidairement responsables du respect de la réglementation. Leurs domaines de responsabilité respectifs doivent être définis par écrit et chacune doit répondre aux exigences de qualification.
Enregistrement et mise en conformité
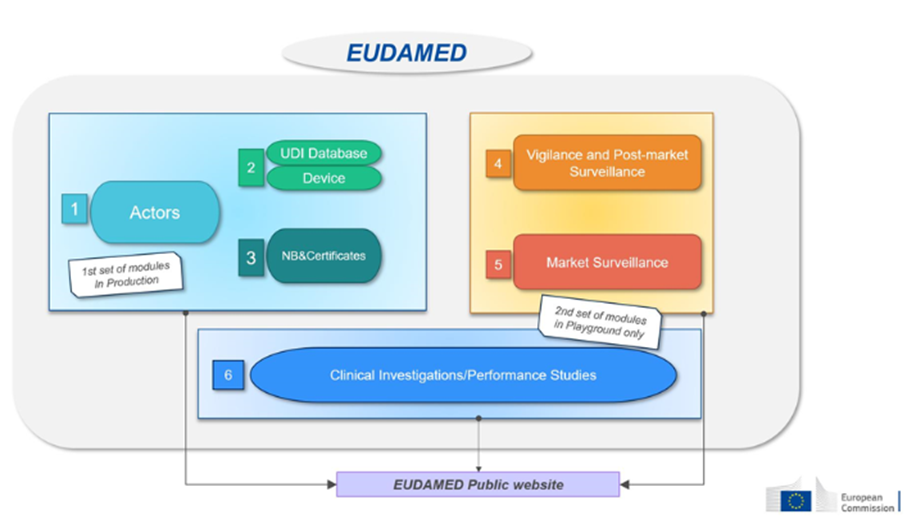
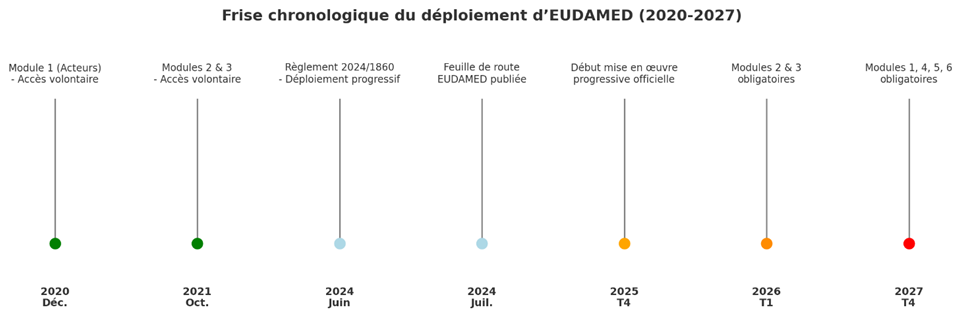
Depuis l’entrée en application du règlement le 26 mai 2021, les coordonnées de la PCVRR doivent obligatoirement être enregistrées dans la base de données EUDAMED (cf. notre Blog Eudamed), la plateforme européenne dédiée aux dispositifs médicaux.
Références utiles :
- Article 15 du règlement (UE) 2017/745 des dispositifs médicaux_
- Article 15 du règlement (UE) 2017/746 des dispositifs médicaux de diagnostic in vitro
- Guide SNITEM – La personne chargée de veiller au respect de la réglementation
*Définition micro et petite entreprise selon la recommandation 2003/361/CE de la Commission du 6 mai 2003 concernant la définition des micro, petites et moyennes entreprises :
Dans la catégorie des PME, une petite entreprise est définie comme une entreprise qui occupe moins de 50 personnes et dont le chiffre d’affaires annuel ou le total du bilan annuel n’excède pas 10 millions d’euros.
Dans la catégorie des PME, une microentreprise est définie comme une entreprise qui occupe moins de 10 personnes et dont le chiffre d’affaires annuel ou le total du bilan annuel n’excède pas 2 millions d’euros.
Article rédigé par Camille NEERMUL, Consultante Qualité et Affaires Réglementaires en dispositifs médicaux