Comprendre EUDAMED : La Base de Données Européenne sur les Dispositifs Médicaux
Le règlement (UE) 2017/745 introduit de nouvelles exigences afin de renforcer la sécurité des patients et utilisateurs. Une des nouveautés de ce nouveau règlement est la création d’une base de données européenne dédiée aux informations sur les dispositifs médicaux appelée EUDAMED.
Cette plateforme sécurisée a pour objectif :
- d’accroître la transparence des informations sur les dispositifs médicaux avec un accès au grand public
- une meilleure coordination entre les États membres dans la surveillance post commercialisation des dispositifs médicaux
- de centraliser les données relatives aux dispositifs mis sur le marché ou faisant l’objet d’investigations cliniques.
Le règlement introduit de nouvelles exigences applicables aux différents acteurs pour EUDAMED.
Cette base de données sera composée de 6 modules connectés les uns aux autres :
| Module : | Qui doit enregistrer des informations ? | Accessible au public | |
| 1-Acteurs | Les opérateurs économiques doivent s’enregistrer en tant qu’acteur dans EUDAMED et fournir les informations requises. | -Fabricants de l’UE et de pays tiers, -Mandataires, -Producteurs d’emballages de systèmes/procédures – Importateurs | Disponible sur base volontaire depuis décembre 2020 et sera obligatoire à partir de T4 2027 |
| 2-Dispositifs | Les fabricants doivent soumettre dans EUDAMED le basic-IUD et les informations de tous les dispositifs qu’ils mettent sur le marché de l’UE. | Uniquement les fabricants Enregistrement des dispositifs médicaux sous MDR Aucune obligation pour les legacy devices (si enregistrement dans EUDAMED, il faudra faire un nouvel enregistrement pour les produits sous MDR, considérés comme de nouveaux produits) | Disponible sur base volontaire depuis octobre 2021 et sera obligatoire à partir de T1 2026 |
| 3-Organismes notifiés (ON) et certificats | Les organismes notifiés (ON) doivent enregistrer dans EUDAMED toute information concernant les certificats délivrés, suspendus, rétablis, retirés ou refusés et les autres restrictions imposées à ces certificats. Ces informations sont accessibles au public. | Organismes Notifiés | Disponible sur base volontaire depuis octobre 2021 et sera obligatoire à partir de T1 2026 |
| 4-Vigilance | Module dédié à tous les rapports de vigilance et de surveillance post-commercialisation. -information de sécurité (Field Safety notice, FSN) – Actions correctives de sécurité (Field Safety Corrective Action, FSCA) -Rapport d’investigation des causes d’incident et mesures correctives (MIR) -Rapport de tendances (trend report) -Rapport périodique de sécurité (PSUR) | Fabricants | Sera obligatoire à partir de T4 2027 |
| 5-Surveillance du marché | La coordination des actions de surveillance de marché entre les différentes autorités compétentes. | Autorités compétentes uniquement | Sera obligatoire à partir de T4 2027 |
| 6-CI/PS : (Clinical investigation/ Performance studies) : | Ce module concerne les enregistrements des investigations cliniques (DM) et études de performance. (DMDIV) Rapport et résumé d’investigation clinique Evènement indésirable grave survenu pendant les investigations cliniques | Promoteurs | Sera obligatoire à partir de T4 2027 |
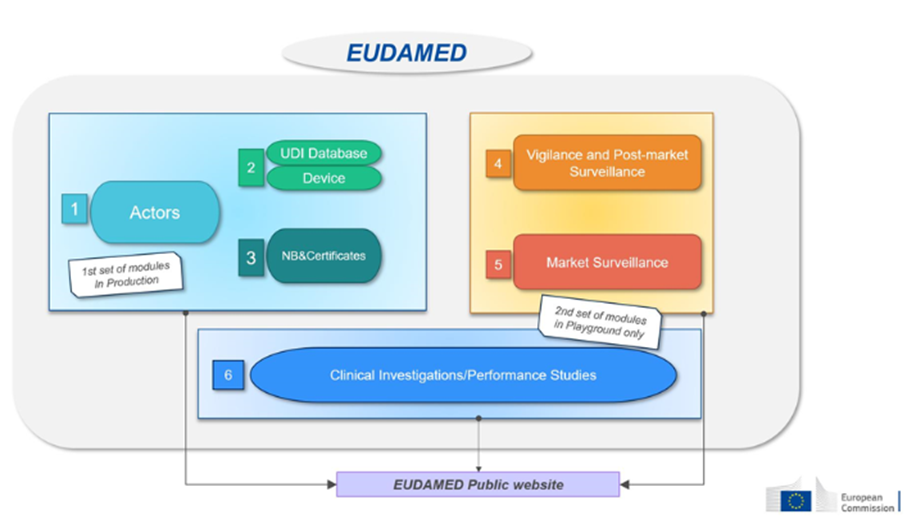
Source : Commission européenne
Et les distributeurs ?
Le MDR n’impose aucune exigence aux distributeurs concernant EUDAMED. Ils n’ont donc aucun accès sécurisé dans EUDAMED et ils ont uniquement l’accès grand public. Certains pays peuvent cependant définir des exigences supplémentaires, c’est le cas de la France qui demande aux distributeurs de s’enregistrer via le formulaire ANSM.
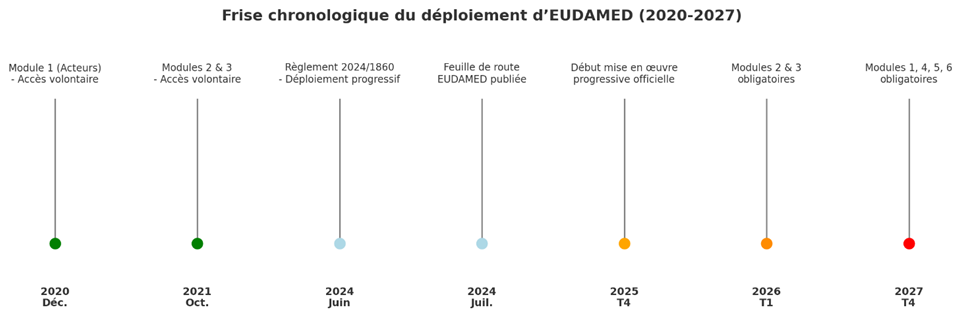
Calendrier de déploiement EUDAMED
En octobre 2019, la Commission européenne avait annoncé le report du lancement d’EUDAMED de 2 ans à mai 2022.
Certains modules sont déjà disponibles et peuvent être utilisés volontairement. Un projet de roadmap est sorti le 10 juillet 2024 indiquant un déploiement total d’EUDAMED prévu au deuxième trimestre 2027. Les dates présentes dans la roadmap d’EUDAMED sont provisoires. Dernièrement, le règlement 2024/1860 du 13 juin 2024 a amendé le règlement (UE) 2017/745 des dispositifs médicaux (MDR) et le règlement (UE) 2017/746 des dispositifs médicaux de diagnostic in vitro (IVDR) concernant le déploiement progressif d’EUDAMED. Il prévoit une mise en œuvre graduelle des modules EUDAMED une fois les modules validés.
- Le déploiement complet est désormais planifié pour fin 2027.
Documents et guides utiles :
- Release note EUDAMED (V2.14)
- Feuille de route EUDAMED
- Règlement (UE) 2024/1860 du Parlement européen et du Conseil du 13 juin 2024 modifiant les règlements (UE) 2017/745 et (UE) 2017/746 en ce qui concerne un déploiement progressif d’EUDAMED, l’obligation d’informer en cas d’interruption ou de cessation d’approvisionnement et les dispositions transitoires applicables à certains dispositifs médicaux de diagnostic in vitro
- FAQ Gradual Roll-out EUDAMED (11/2024)
- Centre d’information EUDAMED


