Historique
En Europe, les informations relatives à la qualité, à la sécurité et à l’efficacité du dossier d’Autorisation de Mise sur le Marché (AMM) des médicaments sont regroupées dans un format commun, appelé format CTD (Common Technical Document). Le format CTD s’applique dans toutes les régions reconnaissant les textes de l’ICH. Il est actuellement organisé selon cinq Modules : le Module 1 est spécifique à la région tandis que les Modules 2, 3, 4 et 5 sont communs à l’ensemble des régions (cf. figure 1).
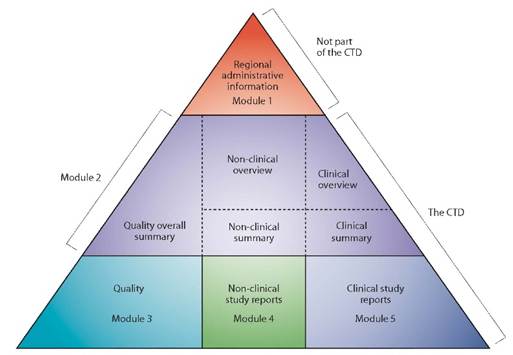
Figure 1 : Le triangle du CTD
Le format CTD, décrit dans l’ICH M4, est devenu le format obligatoire pour les demandes d’AMM de nouveaux médicaments en Europe en juillet 2003. Avant sa mise en œuvre, les dossiers d’AMM répondaient aux exigences du format NtA Volume 2B (Edition 1998).
Pour les industriels, la mise en place du format CTD a permis d’éliminer la nécessité de reformater les informations à soumettre aux différentes autorités réglementaires de l’ICH.
Par la suite, la mise en place du format « eCTD » (electronic Common Technical Document), d’abord rendu obligatoire en Europe en 2007 pour les AMM en procédure centralisée, a révolutionné les pratiques réglementaires en harmonisant les soumissions électroniques auprès des autorités réglementaires de l’ICH, en remplaçant notamment les soumissions au format NeeS (Non-eCTD electronic Submission). Les informations relatives au format eCTD sont disponibles dans l’ICH M8.
Les raisons de la refonte de l’ICH M4Q(R1)
En Europe, le contenu du Module 2.3 (QOS – Quality Overall Summary) et du Module 3 du dossier d’AMM répond aux exigences détaillées dans les lignes directrices ICH M4Q(R1) mises en œuvre en juillet 2003. Aucune révision de ce texte n’a été effectuée depuis plus de 20 ans, ce qui a conduit les législateurs à plusieurs constats :
Constat #1) La structure CTD traditionnelle n’est pas adaptée à la prise en charge des concepts modernes de qualité.
Depuis la publication de l’ICH M4Q(R1), de nouvelles lignes directrices ICH Q8 à ICH Q14 ont été élaborées, introduisant des concepts novateurs tels que la qualité par la conception (QbD – Quality by Design), la gestion des risques qualité (QRM – Quality Risk Management) et les approches fondées sur le cycle de vie (LCM – Life Cycle Management), ainsi que la fabrication continue (CM – Continous Manufacturing).
Le document ICH M4Q(R1) n’a pas été conçu pour tenir compte des nouveaux principes de qualité et leur intégration dans le format CTD actuel n’est pas aisée.
Constat #2) La structure CTD traditionnelle n’est pas adaptée à la prise en charge de l’évolution des technologies et des types de produits.
L’ICH M4Q(R1) a été conçu principalement pour les petites molécules conventionnelles et s’articule autour de la substance active (partie 32S) et du produit fini (partie 32P), avec des adaptations pour les produits biologiques. L’expérience a démontré que les produits complexes et les nouvelles modalités thérapeutiques (nanomédicaments, oligonucléotides et produits biologiques tels que les vaccins, les thérapies cellulaires et géniques et les produits issus de l’ingénierie tissulaire) ainsi que les produits combinés ne s’inscrivent souvent pas parfaitement dans ce cadre.
Constat #3) La structure CTD traditionnelle génère une ambiguïté dans l’organisation et le placement des informations.
Le format modulaire requis (i.e. résumé des données qualité versé dans le Module 2.3 et informations détaillées versées dans le Module 3) laisse place à des interprétations divergentes quant aux détails à inclure dans le Module 2.3 par rapport au Module 3 et conduit souvent à des répétitions d’informations. Une ambiguïté subsiste quant à l’emplacement des informations et aux références croisées entre les modules.
La gestion des mises à jour et des variations d’AMM tout le long du cycle de vie tout en conservant la cohérence dans la structure du CTD avec l’ICH M4Q(R1) n’est pas optimale.
Constat #4) La structure CTD traditionnelle laisse subsister des différences régionales.
Malgré l’harmonisation du format des dossiers au sein de l’ICH, des exigences supplémentaires spécifiques à certains pays/régions persistent souvent, réduisant ainsi l’avantage d’avoir un format unique.
Constat #5) Le format eCTD actuel ne permet pas d’intégrer les nouvelles exigences en matière de données électroniques et structurées.
La tendance actuelle s’oriente vers des soumissions structurées, lisibles par des machines et vers l’utilisation de normes relatives aux données (ex : ISO IDMP 11615), en lien avec la future mise en œuvre du SPQS (Structured Product Quality Submission) par l’EMA qui conduira aux future lignes directrices ICH M16 (cf. figure 2).
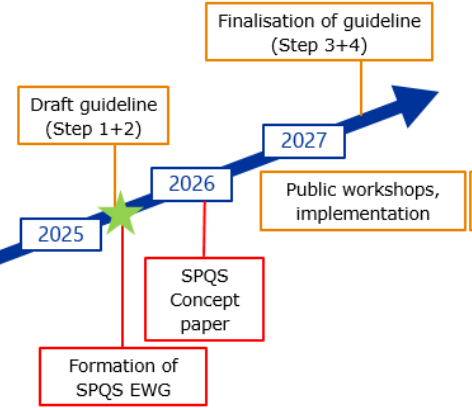
Figure 2 : Interactions entre ICH M4Q(R2) et SPQS (future ICH M16)
L’ICH M4Q(R1) n’a pas été conçu pour de tels contenus structurés ce qui complique l’automatisation et empêche la réutilisation des données entre les soumissions.
Pour toutes ces raisons, l’ICH MQ4(R1) doit donc être repensée, pour permettre la gestion et la normalisation des données, et favoriser ainsi l’efficacité du processus d’examen et d’approbation des dossiers.
Aperçu de la révision d’ICH M4Q(R1) : cadre actuel versus cadre futur
Bien que des changements soient apportés à l’emplacement des informations dans les futurs Modules 2.3 et 3, ceux-ci ne modifient en rien les attentes réglementaires. Les données servant de base pour l’évaluation réglementaire, auparavant présentées dans le Module 3 figureront désormais dans le Module 2.3. Le Module 3 servira désormais de référentiel de données techniques (protocoles, rapports, données, …) (cf. figure 3).
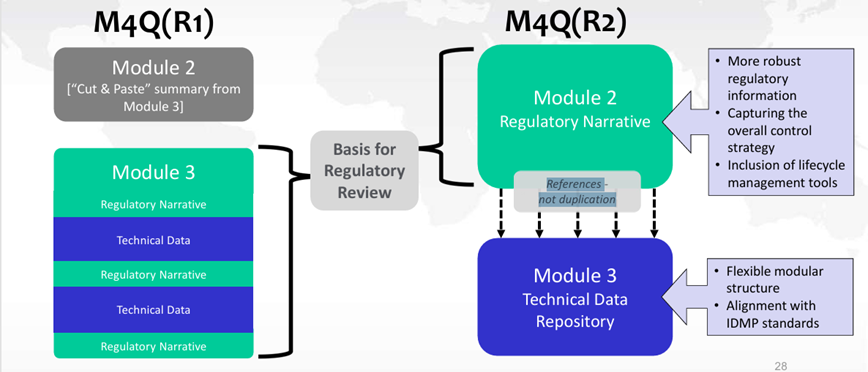
Figure 3 : Changements de l’emplacement des données entre ICH M4Q(R1) et ICH M4Q(R2)
La future granularité du Module 2.3 et du Module 3, telle que pressentie dans la version « draft » du 14 mai 2025 de l’ICH M4Q(R2) est présentée en figure 4 et en figure 5.

Figure 4: Granularité du Module 2.3 selon ICH M4Q(R2) (1)

Figure 4 : Granularité du Module 2.3 selon ICH M4Q(R2) (2)

Figure 4 : Granularité du Module 2.3 selon ICH M4Q(R2) (3)
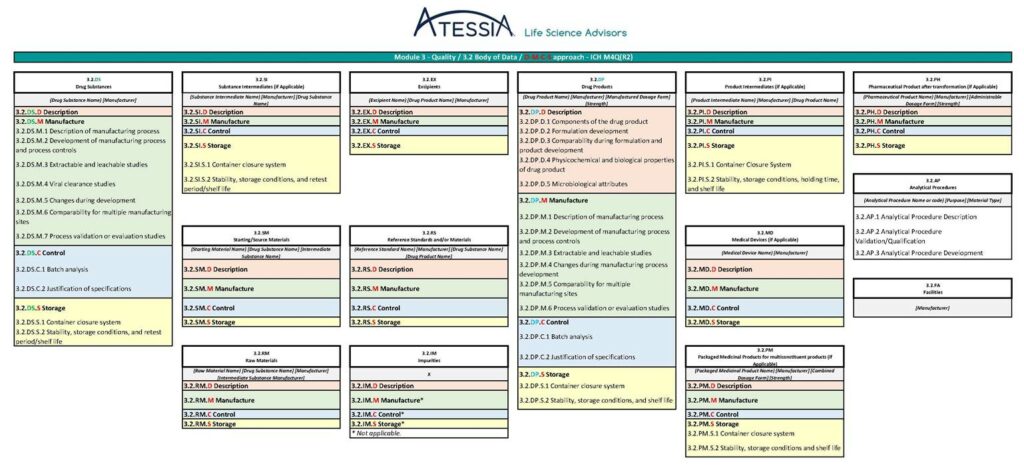
Figure 5 : Granularité du Module 3 selon ICH M4Q(R2)
Les informations essentielles sur la qualité (2.3.3 Core Quality Information (CQI)) :
– devront inclure toutes les informations assujetties à la gestion du cycle de vie conformément aux exigences régionales en matière de modifications post-AMM afin de garantir la qualité du produit.
– devront être conservées tout au long du cycle de vie du produit afin de garantir que les informations relatives à la qualité du produit restent à jour.
Les informations contenues dans les sections 2.3.1 (General Information), 2.3.2 (Overall Development and Overall Control Strategy), 2.3.4 (Development Summary and Justification), 2.3.5 (Product Lifecycle Management), 2.3.6 (Product Quality Benefit Risk) et le Module 3 seront des informations supportives, pouvant être modifiées ou complétées pour les soumissions post-AMM.
Dans la future ICH M4Q(R2), les informations seront regroupées dans des sous-sections spécifiques des matériaux/composants mis en œuvre dans la fabrication :
- les substances médicamenteuses (DS),
- les substances intermédiaires (SI),
- les matières premières (RM),
- les matières de départ (SM),
- les excipients (EX),
- les substances de référence (RS),
- les impuretés (IM),
- les médicaments (DP),
- les produits intermédiaires (PI),
- les médicaments conditionnés (PM),
- les produits pharmaceutiques (PH) et
- les dispositifs médicaux (MD).
Les informations relatives aux procédures analytiques et aux installations qui s’appliquent à tous les matériaux seront présentées dans des sections dédiées.
Chaque sous-section sera ensuite organisée selon la structure DMCS suivante :
- Description / Description : identifie le matériau/composant et ses principales caractéristiques ;
- Fabrication / Manufacture : décrit le procédé de production et les contrôles du procédé ;
- Contrôle / Control : décrit les mesures de contrôle de la qualité telles que les spécifications ;
- Stockage / Storage : fournit des informations sur le système de fermeture des contenants, la stabilité, les conditions de stockage et la période de recontrôle/durée de conservation.
Les relations entre le module 2.3 et le module 3 dans le contexte du modèle DMCS utilisé pour les matériaux/composants sont illustrées comme suit :
| 2.3.3 Core Quality Information | 2.3.4 Development Summary and Justification | 3.2 Body of Data | |
| Informations relatives à la nature du produit et à ses principales caractéristiques, jugées nécessaires pour permettre l’autorisation de mise sur le marché et faciliter la gestion du cycle de vie | Résumé scientifique et fondé sur les risques et justifications relatives à la nature du matériau et à ses principales caractéristiques | Informations supportives, notamment des rapports et des données sur la nature du matériau et ses principales caractéristiques | |
| Description | Nomenclature, structure, composition, caractéristiques clés | Résumé de la caractérisation, développement de la formulation et justification | Données de caractérisation, développement de formulations et données justificatives |
| Fabrication | Description du processus de fabrication, IPC, paramètres critiques des procédés | Résumé du développement et de la validation/évaluation des procédés | Données relatives au développement et à la validation/évaluation des procédés |
| Contrôle | Spécifications | Aperçu de l’analyse par lots, justification des spécifications | Données d’analyse de lots et justification |
| Stockage | Description du conditionnement, des conditions de stockage et période de recontrôle/durée de conservation | Aperçu des études de stabilité, justification du conditionnement proposé | Choix du conditionnement et données relatives à la stabilité |
Conclusion
En conclusion, l’ICH M4Q(R2) vise à favoriser l’harmonisation du contenu qualité des dossiers, afin de permettre, dans l’idéal, la soumission d’un dossier unique dans tous les pays membres de l’ICH.
Lorsque la loi l’exige, le demandeur devra fournir toute information supplémentaire spécifique à la région directement dans la section correspondante dans un document séparé, sous forme d’addendum au document de base harmonisé utilisé dans toutes les régions de l’ICH.
Atessia accompagne le secteur dans la rédaction des Modules 2.3 et 3.
Sources :
– ICH M4 Organisation Including the Granularity document that provides guidance on document location and pagination
– Notice to Applicants, Volume 2B incorporating the Common Technical Document (CTD) (May 2008)
– ICH M4Q(R1) CTD on Quality
– ICH M4Q Q&As (R1) Questions & Answers: CTD on Quality
– ICH M4Q(R2) EWG Revision of M4Q(R1) (draft guideline 14 May 2025)
– M4Q(R2) Step 2 presentation (18 June 2025)
– Présentation Finding your way with the new eCTD (ICH-M4Q), Ivica Malnar, Agency for Medicinal Products and Medical Devices (HALMED) (23-24 September 2025)
– ICH M8 electronic Common Technical Document (eCTD) v3.2.2
– ICH M8 electronic Common Technical Document (eCTD) v4.0
Article rédigé par Isabelle MOUVAULT, Consultante Sénior en Affaires Pharmaceutiques

