Présentation de l’ICH (rôles, histoire, missions,…)
L’ICH (conseil international d’harmonisation des exigences techniques pour l’enregistrement des produits pharmaceutiques à usage humain) est une organisation rassemblant les autorités réglementaires et l’industrie pharmaceutique afin de discuter des aspects techniques et scientifiques de l’enregistrement des médicaments.
Cette instance élabore notamment des lignes directrices harmonisées pour le développement pharmaceutique mondial : les « lignes directrices de l’ICH ».
Depuis sa création en 1990, l’ICH a pour mission de parvenir à une meilleure harmonisation à l’échelle mondiale, dans le but d’assurer, avec efficience, le développement et l’enregistrement de médicaments sans danger, efficaces et de qualité.
Comme d’autres organisations, l’ICH a dû s’adapter à une industrie pharmaceutique de plus en plus mondialisée.
L’ICH a été créée en 1990 et s’est d’abord appelée Conférence internationale sur l’harmonisation (ICH). Lors de la première réunion du comité directeur de l’ICH, il a été décidé que les sujets sélectionnés pour l’harmonisation seraient divisés en trois domaines distincts afin de refléter les critères qui constituent la base de l’approbation et de l’autorisation des nouveaux médicaments : Sécurité (S), Qualité (Q) et Efficacité (E).
Les sujets transversaux qui n’entrent pas uniquement dans l’une de ces trois catégories relèvent du domaine Multidisciplinaire (M). Il s’agit notamment de la terminologie médicale « MedDRA », du format technique commun « CTD » et de l’élaboration de normes électroniques pour le transfert d’informations réglementaires « ESTRI ».
L’Assemblée de l’ICH, organe central et instance dirigeante de l’organisation, en réunit la totalité des membres et observateurs.
Depuis octobre 2015, l’ICH s’est développée en tant qu’organisation et compte désormais 23 membres et 38 observateurs.
En qualité d’observateur, l’EDQM contribue à l’élaboration des lignes directrices ICH dans plusieurs de ses domaines d’intervention (par ex : contrôle des impuretés, mise au point et validation des procédures analytiques et fabrication en continu).
Les évolutions de l’ICH
Depuis sa création, l’ICH a progressivement évolué pour répondre aux enjeux de plus en plus globaux du domaine pharmaceutique.
Nous reprenons ici les dates clés :
>1980s : Lancement de l’harmonisation des exigences réglementaires par la CE, alors que l’Europe s’achemine vers le développement d’un marché unique pour les produits pharmaceutiques. Parallèlement, des discussions ont lieu entre l’Europe, le Japon et les États-Unis sur les possibilités d’harmonisation.
>1989 : Des plans d’action spécifiques pour l’harmonisation commencent à se concrétiser lors de la Conférence des autorités de réglementation pharmaceutique de l’OMS (ICDRA) à Paris. Peu après, les autorités prennent contact avec la Fédération internationale de l’industrie du médicament (FIIM) pour discuter d’une initiative conjointe des autorités réglementaires et de l’industrie en matière d’harmonisation internationale, et c’est ainsi qu’est née l’ICH.
>Avril 1990 : naissance de l’ICH lors d’une réunion organisée par l’EFPIA à Bruxelles. Les représentants des agences de réglementation et des associations industrielles d’Europe, du Japon et des États-Unis se sont réunis principalement pour planifier une conférence internationale, mais la réunion a également discuté des implications plus larges et du mandat de l’ICH.
Désormais dans sa quatrième décennie d’activité, l’ICH cherche à étendre les avantages de l’harmonisation au-delà de ses régions fondatrices (Europe, États-Unis et Japon). Pour ce faire, une série de changements organisationnels ont eu lieu en 2015. Ces changements ont constitué un certain nombre de réformes, notamment : accroître la portée internationale ; modifier la structure de gouvernance de l’ICH ; diffuser davantage d’informations sur les processus de l’ICH à un plus grand nombre de parties prenantes ; et établir l’ICH en tant qu’entité juridique afin de fournir une structure de fonctionnement plus stable.
L’association ICH qui en résulte établit une assemblée en tant qu’organe directeur général dans le but de concentrer les travaux d’harmonisation de la réglementation pharmaceutique mondiale en un seul lieu qui permette aux autorités de réglementation pharmaceutique et notamment aux organisations industrielles concernées de participer plus activement aux travaux d’harmonisation de l’ICH.
Les domaines d’activités de l’ICH
Les travaux menés par l’ICH relèvent de quatre domaines : les activités d’harmonisation, l’élaboration des lignes directrices, l’élaboration de standards (dictionnaire MedDRA, format CTD ou standards électroniques ESTRI) et d’autres travaux (par ex : élaboration de documents de réflexion).
Le processus d’élaboration des lignes directrices de l’ICH
Les activités d’harmonisation de l’ICH se répartissent en 4 catégories : Procédure formelle de l’ICH, procédure de questions-réponses, procédure de révision et procédure de mise à jour, en fonction de l’activité à entreprendre.
Chaque activité d’harmonisation est initiée par un document de réflexion qui est un bref résumé de la proposition. Selon la catégorie de l’activité d’harmonisation, un plan d’activité peut également être requis. Le plan d’activité décrit les coûts et les avantages de l’harmonisation du sujet proposé dans le document de réflexion.
La procédure formelle de l’ICH (une procédure progressive en 5 étapes) est suivie pour l’harmonisation de tous les nouveaux thèmes de l’ICH.
La procédure débute par l’approbation par l’assemblée de l’ICH d’un document de réflexion et d’un plan d’activité. Un groupe de travail d’experts (EWG) est ensuite créé.
Ce groupe travaille à l’élaboration d’un projet de ligne directrice et le fait passer par les différentes étapes de la procédure, qui aboutissent à l’étape 5 et à la mise en œuvre d’une ligne directrice harmonisée dans les régions de l’ICH.
Les cinq étapes sont les suivantes :
- Étape 1 : Recherche d’un consensus
- Étape 2a : Confirmation du consensus sur le document technique
- Étape 2b : Adoption du projet de ligne directrice par les membres réglementaires
- Étape 3 : Consultation réglementaire et discussion
- Étape 4 : Adoption d’une ligne directrice harmonisée de l’ICH
- Étape 5 : Mise en œuvre
Le processus d’implémentation des guidelines de l’ICH
À l’étape 5 du processus ICH, les lignes directrices harmonisées de l’ICH sont mises en œuvre par les membres régulateurs et les observateurs de l’ICH dans leur pays/région respectif. Cela est conforme aux statuts de l’ICH et à l’objectif et à l’intention de tous les membres régulateurs de l’ICH de mettre en œuvre toutes les lignes directrices de l’ICH.
Pour les observateurs réglementaires de l’ICH, la mise en œuvre de (certaines) lignes directrices est une condition préalable pour devenir membre réglementaire de l’ICH.
Les lignes directrices de l’ICH sont mises en œuvre conformément aux règles nationales/locales/régionales applicables, le stade de mise en œuvre de toutes les lignes directrices de l’ICH dépendant également de la date d’adhésion d’un membre ou d’un observateur à l’ICH.
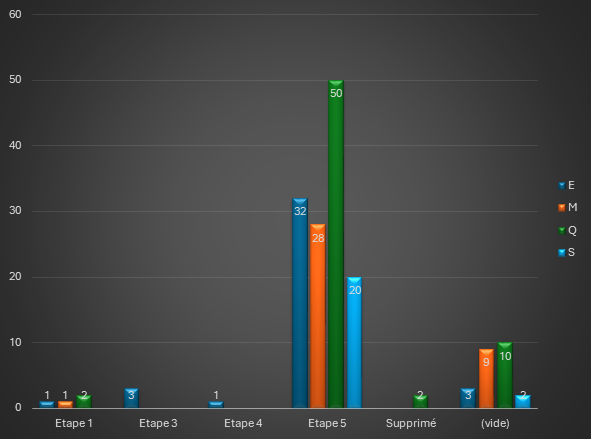
En avril 2025, un total de 163 lignes directrices (tous domaines confondus) étaient publiées sur le site internet de l’ICH, répartis comme indiqué dans le graphique ci-dessous :
Les futurs travaux de l’ICH impactant la réglementation mondiale
L’ICH continue de proposer des lignes directrices sur des sujets relatifs au développement pharmaceutique nécessitant une harmonisation réglementaire ou pour lesquels une absence de recommandations a été identifiée. C’est le cas par exemple du (très attendu) projet de ligne directrice ICH Q3E sur les extractibles et relargables.
En outre, la mise à jour des lignes directrices actuelles est également soutenue, afin de tenir compte des progrès scientifiques. C’est le cas notamment de la récente mise à jour de la ligne directrice ICH Q2 sur les validations analytiques ou encore la révision à venir de la série de lignes directrices relatives à la stabilité ICH Q1A-Q1F.
Sources :
EDQM – Harmonisation internationale
Article rédigé par Isabelle MOUVAULT, Consultante Sénior en Affaires Pharmaceutiques

